PRODUKTRESUMÉ Elvanse ADHD Medicin är kanske mest känd än så länge för det första märket av Lisdexamfetamin som kom på marknaden dvs Vyvanse dock inte i Sverige. Här är Elvanse det första medlet som godkännts för behandling av ADHD och ADD innehållande just Lisdexamfetamin.
- LÄKEMEDLETS NAMN ELVANSE
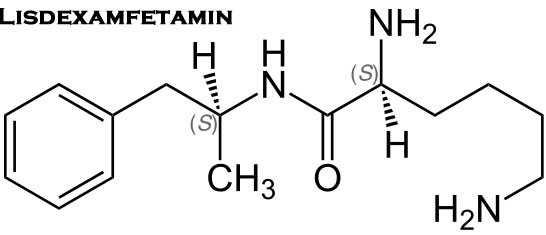
Elvanse Lisdexamfetamnin
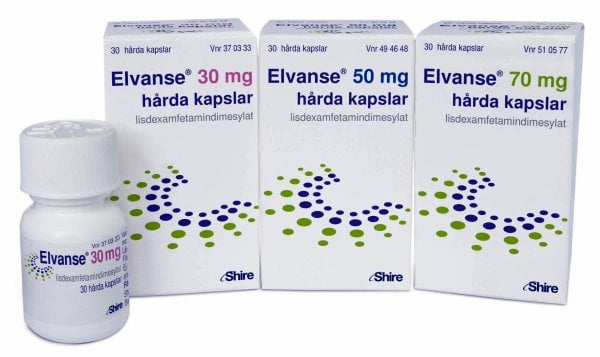
Elvanse 30 mg - Elvanse 50 mg - Elvanse 70 mg
- KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
Kapslar 30 mg: En kapsel innehåller 30 mg lisdexamfetamindimesylat, motsvarande 8,9 mg dexamfetamin.
Kapslar 50 mg: En kapsel innehåller 50 mg lisdexamfetamindimesylat, motsvarande 14,8 mg dexamfetamin
Kapslar 70 mg: En kapsel innehåller 70 mg lisdexamfetamindimesylat, motsvarande 20,8 mg dexamfetamin.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
- LÄKEMEDELSFORM
Kapsel, hård
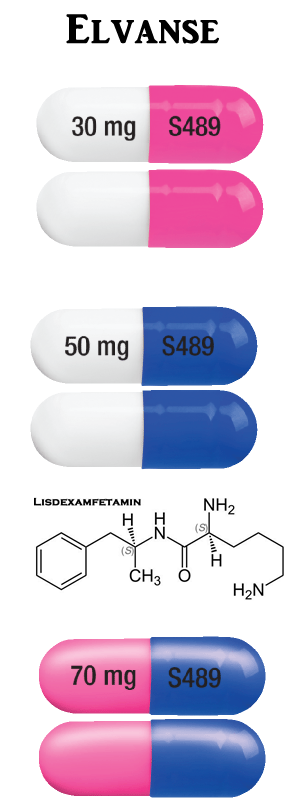
Elvanse 30 mg kapsel: ogenomskinlig med vit underdel och rosa överdel, märkt med ”S489” och ”30 mg” i svart bläck.
Elvanse 50 mg kapsel: ogenomskinlig med vit underdel och blå överdel, märkt med ”S489” och ”50 mg” i svart bläck.
Elvanse 70 mg kapsel: ogenomskinlig med blå underdel och rosa överdel, märkt med ”S489” och ”70 mg” i svart bläck.
Längd: ca 16 mm, bredd: ca 6 mm.
- Kliniska UPPGIFTER
4.1 Terapeutiska indikationer
Elvanse är indicerat som en del i ett omfattande behandlingsprogram anpassat för ADHD (Attention Deficit Hyperactivity Disorder, Uppmärksamhetsstörning/Hyperaktivitet) hos barn i åldern 6 år och äldre, när svar på tidigare behandling med metylfenidat bedöms vara kliniskt otillräckligt
Behandlingen ska ske under överinseende av specialist på beteendestörningar hos barn och/eller ungdomar. Diagnos ska ställas enligt kriterierna i DSM-IV eller riktlinjerna i ICD-10 och ska grundas på fullständig anamnes och utvärdering av patienten. Diagnos kan inte ställas enbart på närvaro av ett eller flera symtom.
Den specifika etiologin för detta syndrom är okänd, och det finns inget enstaka diagnostiskt test. Adekvat diagnos kräver användning av såväl medicinska som specialiserade psykologiska, pedagogiska och sociala resurser. Ett omfattande behandlingsprogram karaktäriseras av psykologiska, pedagogiska och sociala åtgärder såväl som farmakoterapi och har som målsättning att stabilisera barn med ett beteendesyndrom karaktäriserat av symtom som kan inkludera kronisk anamnes av kort uppmärksamhetsperiod, distraherbarhet, emotionell labilitet, impulsivitet, måttlig till svår hyperaktivitet, mindre uttalade neurologiska tecken och onormalt EEG. Syndromet kan förekomma både med och utan inlärningssvårigheter.
Behandling med Elvanse är inte indicerat för alla barn med ADHD och beslutet att använda läkemedlet måste grundas på en mycket noggrann bedömning av svårighetsgrad och kronicitet av barnets symtom i förhållande till barnets ålder och risk för missbruk, felanvändning eller avvikande användning.
Tillgång till lämplig undervisningsform är väsentlig, och psykosocial intervention är i allmänhet nödvändigt. Användning av Elvanse ska alltid ske på detta sätt enligt godkänd indikation.
Elvanse
4.2 Dosering och administreringssätt
Behandlingen ska påbörjas under överinseende av specialist på beteendestörningar hos barn och/eller ungdomar.
Dosering
Dosen ska anpassas till patientens terapeutiska behov och respons. Noggrann dostitrering krävs vid start av behandling med Elvanse.
Startdosen för alla patienter, antingen vid påbörjad behandling av ADHD eller vid byte från ett annat läkemedel, är 30 mg som tas en gång dagligen på morgonen.
Dosen kan ökas stegvis med 20 mg, med cirka en veckas intervall. Elvanse ska ges peroralt i lägsta effektiva dos.
Den högsta rekommenderade dosen är 70 mg dagligen. Högre doser har inte studerats.
Behandlingen måste upphöra om symtomen inte förbättras efter lämplig dosjustering under en månad. Om paradoxal försämring av symtomen eller andra allvarliga biverkningar uppträder ska dosen minskas eller behandlingen avslutas.
Administreringssätt
Elvanse kan tas oberoende av måltid.
Kapslarna kan sväljas hela eller öppnas och innehållet lösas upp i ett glas vatten. Om pulvret i kapseln har packats ihop, kan en sked användas för att lösa upp det i vattnet. Innehållet ska blandas tills det är helt upplöst. Patienten ska omedelbart dricka hela innehållet i glaset. Blandningen ska inte sparas. Den aktiva substansen löses fullständigt, men en beläggning innehållande de inaktiva substanserna kan finnas kvar i glaset när vattnet har druckits upp. Patienten ska inte ta mindre än en kapsel per dag och kapseln får inte delas.
Vid glömd dos kan behandlingen med Elvanse fortsätta med nästa dos nästkommande dag som planerat. Eftermiddagsdoser bör undvikas eftersom det kan orsaka insomningssvårigheter.
Undersökningar före behandling
Före förskrivning skall en bedömning genomföras av patientens utgångsvärde avseende kardiovaskulär status inklusive blodtryck och hjärtfrekvens. En omfattande anamnes ska dokumentera samtidig annan medicinering, nuvarande och tidigare medicinska och psykiska sjukdomar eller symtom, familjeanamnes av plötslig kardiell eller oförklarad död och noggrann journalföring av längd och vikt på tillväxtdiagram före behandling (se avsnitt 4.3 och 4.4).
I överensstämmelse med användning av andra stimulantia ska risken för missbruk, felanvändning eller avvikande användning beaktas före förskrivning av Elvanse (se avsnitt 4.4).
Kontinuerlig uppföljning
Tillväxt, psykiatriskt och kardiovaskulär status bör regelbundet kontrolleras (se även avsnitt 4.4).
- Blodtryck och puls ska journalföras i ett percentildiagram vid varje dosjustering och minst var sjätte månad.
- Längd, vikt och aptit ska journalföras minst var sjätte månad med hjälp av ett tillväxtdiagram.
- Utveckling av nya eller försämring av redan existerande psykiska störningar ska kontrolleras vid varje dosjustering och därefter minst var sjätte månad samt vid varje besök.
Patienterna ska följas upp avseende risk för avsteg från dos, felanvändning och missbruk av Elvanse.
Långtidsbehandling
Farmakologisk behandling av ADHD kan behövas under längre perioder. Läkare som väljer att använda Elvanse under längre perioder (mer än 12 månader) ska omvärdera nyttan av läkemedlet minst en gång per år och överväga försöksperioder utan behandling för att bedöma hur patienten fungerar utan läkemedel, företrädesvis under skollov.
Vuxna
Hos ungdomar vars symtom kvarstår i vuxen ålder och som har haft klar nytta av behandlingen kan det vara lämpligt att fortsätta behandlingen i vuxen ålder (se avsnitt 4.4 och 5.1).
Barn under 6 år
Elvanse ska inte användas till barn under 6 år. Säkerhet och effekt i denna åldersgrupp har inte fastställts.
Äldre patienter
Clearance av dexamfetamin är nedsatt hos äldre patienter varför dosjustering kan behövas (se avsnitt 5.2).
Patienter med nedsatt njur- eller leverfunktion
Inga studier har utförts på patienter med nedsatt njur- eller leverfunktion. Det har inte påvisats något samband mellan kreatininclearance och farmakokinetiken av amfetamin hos äldre patienter (se avsnitt 5.2). Dosreduktion kan behövas hos patienter med nedsatt njurfunktion.
4.3 Kontraindikationer
Överkänslighet mot sympatomimetiska aminer eller mot något hjälpämnesom anges i avsnitt 6.1.
Samtidig användning av monoaminoxidas (MAO)-hämmare eller inom 14 dagar efter att dessa läkemedel har satts ut på grund av risk för hypertensiv kris; se avsnitt 4.5.
Hypertyroidism eller tyreotoxikos.
Agitationstillstånd.
Symtomatisk kardiovaskulär sjukdom.
Avancerad arterioskleros.
Måttlig till svår hypertoni.
4.4 Varningar och försiktighet
Missbruk och beroende
Vid behandling med stimulantia inklusive Elvanse föreligger risk för missbruk, felanvändning, beroende eller avvikande dosering, vilket ska beaktas vid förskrivning av detta läkemedel. Stimulantia ska förskrivas med försiktighet till patienter med läkemedelsmissbruk eller beroende i anamnesen.
Toleransutveckling, starkt psykiskt beroende och svår social funktionsnedsättning har förekommit vid missbruk av stimulantia. Det finns rapporter om patienter som har använt flera gånger högre doser av amfetamin än de rekommenderade; abrupt utsättande efter längre tids behandling med höga doser leder till extrem trötthet och depression. Förändringar kan även ses på sömn-EEG. Tecken på kronisk intoxikation med amfetaminer kan omfatta allvarliga dermatoser, uttalad insomni, irritabilitet, hyperaktivitet och personlighetsförändringar. Det allvarligaste tecknet på kronisk intoxikation är psykos, som ofta inte går att skilja kliniskt från schizofreni.
Kardiovaskulära biverkningar
Plötslig död hos patienter med existerande kardiella defekter eller andra allvarliga hjärtproblem
Barn och ungdomar: Plötslig död har rapporterats hos barn och ungdomar i samband med CNS-stimulerande medel, varav somliga hade kardiella defekter eller andra allvarliga hjärtproblem. Även om vissa allvarliga hjärtproblem i sig kan innebära en ökad risk för plötslig död, ska inte stimulantia ges till barn eller ungdomar med kända allvarliga kardiella defekter, kardiomyopati, allvarliga hjärtrytmrubbningar eller andra allvarliga hjärtproblem som kan göra dem extra känsliga för de sympatomimetiska effekterna av ett stimulerande läkemedel.
Vuxna:Plötslig död, stroke och hjärtinfarkt har rapporterats hos vuxna i samband med stimulerande läkemedel i de normala doser som användes för ADHD. Även om funktionen av stimulantia hos vuxna i dessa fall är okänd, är det större sannolikhet att vuxna, i jämförelse med barn, har existerande allvarliga kardiella defekter, kardiomyopati, allvarliga hjärtrytmstörningar, kranskärlssjukdom eller andra allvarliga hjärtproblem. Vuxna med sådana avvikelser bör i allmänhet inte behandlas med stimulerande läkemedel.
Hypertoni och andra kardiovaskulära tillstånd
Stimulerande läkemedel orsakar en obetydlig ökning av genomsnittligt blodtryck (cirka 2–4 mmHg) och av genomsnittlig hjärtfrekvens (cirka 3–6 slag per minut), och större individuella ökningar kan förekomma. Även om de genomsnittliga förändringarna i sig inte förväntas ha kortsiktiga konsekvenser, bör samtliga patienter övervakas med avseende på större förändringar i hjärtfrekvens och blodtryck. Försiktighet ska iakttas vid behandling av patienter vars underliggande medicinska tillstånd kan försämras av ökat blodtryck eller ökad hjärtfrekvens, t.ex. de med existerande hypertoni, hjärtsvikt, nyligen genomgången hjärtinfarkt eller ventrikulär arytmi.
Användning av Elvanse är kontraindicerad till patienter med symtomatisk kardiovaskulär sjukdom och även till patienter med måttlig till svår hypertoni (se avsnitt 4.3).
Kardiomyopati
Kardiomyopati har rapporterats vid kronisk användning av amfetamin. Det har även rapporterats med Elvanse.
Bedömning av kardiovaskulärt status hos patienter som behandlas med stimulerande läkemedel
För patienter för vilka behandling med stimulerande medel övervägs ska en noggrann genomgång av anamnes (inklusive bedömning av familjeanamnes av plötslig död eller ventrikulär arytmi) och läkarundersökning göras för att bedöma förekomst av hjärtsjukdom. Ytterligare kardiell utredning ska göras om fynden tyder på sådan sjukdom (t.ex. elektrokardiogram [EKG] eller ultraljudsundersökning). Patienter som utvecklar symtom som ansträngningsutlöst bröstsmärta, oförklarad synkopé eller andra symtom som tyder på hjärtsjukdom under behandling med stimulantia ska genomgå en omedelbar hjärtundersökning.
Psykiska biverkningar
Existerande psykos
Stimulantia kan förvärra symtom på beteende- och tankestörning hos psykotiska patienter.
Bipolär sjukdom
Särskild försiktighet bör iakttas vid användning av stimulantia för behandling av ADHD-patienter med samtidig bipolär sjukdom på grund av möjlig induktion av blandad/manisk episod hos sådana patienter. Före initiering av behandling med ett stimulerande läkemedel bör patienter med samtidiga depressiva symtom undersökas för utvärdering av eventuell risk för bipolär sjukdom. En sådan undersökning bör omfatta en detaljerad psykiatrisk anamnes samt familjeanamnes avseende förekomst av självmord, bipolär sjukdom eller depression.
Uppkomst av nya psykotiska eller maniska symtom
Behandlingsutlösta psykotiska eller maniska symtom, t.ex. hallucinationer, vanföreställningar eller mani hos barn eller ungdomar utan tidigare psykotisk sjukdom eller mani i anamnesen kan orsakas av stimulantia vid normala doser. Om sådana symtom uppträder bör det stimulerande läkemedlet övervägas som eventuell orsak och utsättande av behandlingen kan vara lämplig.
Aggression
Aggressivt eller fientligt beteende observeras ofta hos barn och ungdomar med ADHD och har rapporterats i kliniska prövningar och noterats efter godkännandet av vissa läkemedel för behandling av ADHD, däribland Elvanse. Stimulantia kan orsaka aggressivt eller fientligt beteende. Patienter som påbörjar behandling för ADHD ska övervakas med avseende på uppträdande eller förvärrande av aggressivt beteende eller fientlighet.
Tics
Förvärrande av motoriska och verbala tics samt Tourettes syndrom har rapporterats i samband med behandling med stimulantia. Klinisk utvärdering avseende tics och Tourettes syndrom hos barn och deras familjer bör göras innan användning av stimulerande läkemedel.
Långsiktig tillväxthämning (längd och vikt)
Stimulantia har förknippats med långsammare viktökning och minskad slutlängd. Tillväxten ska kontrolleras under behandling med stimulantia. För patienter som inte växer eller ökar i vikt som förväntat kan behandlingen behöva avbrytas. Längd, vikt och aptit ska journalföras minst var sjätte månad.
I en kontrollerad studie med patienter i åldern 6 till 17 år var den genomsnittliga förändringen (SD) av kroppsvikt efter sju veckor −2,35 (2,084) kg för Elvanse, +0,87 (1,102) kg för placebo och −1,36 (1,552) kg för metylfenidathydroklorid.
Kramper
Vissa kliniska studier tyder på att stimulantia kan sänka kramptröskeln hos patienter med kramper i anamnesen, hos patienter med tidigare EEG-avvikelser utan kramper och, i sällsynta fall, hos patienter utan kramper i anamnesen eller tidigare EEG-avvikelser. Vid nytillkomna eller förvärrade kramper ska läkemedlet sättas ut.
Synstörning
Ackommodationssvårigheter och dimsyn har rapporterats i samband med behandling med stimulantia.
Förskrivning och utlämning
För att minska risken för överdosering ska Elvanse förskrivas och utlämnas med minsta möjliga mängd.
Användning tillsammans med andra sympatomimetiska läkemedel
Elvanse bör användas med försiktighet hos patienter som använder andra sympatomimetiska läkemedel (se avsnitt 4.5).
Användning hos vuxna
Säkerhet och effekt för fortsatt rutinmässig behandling efter 18 års ålder har inte fastställts. Om behandlingsutsättning inte har varit framgångsrik hos en ungdom som nått 18 års ålder kan fortsatt behandling i vuxen ålder vara nödvändig. Behovet av ytterligare behandling av dessa vuxna ska ses över regelbundet och avgöras årligen.
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Enzymhämning in vitro
In vitro-försök med humana mikrosomer tyder på svag hämning av CYP2D6 av amfetamin och svag hämning av CYP1A2, 2D6 och 3A4 av en eller flera metaboliter. Även om den kliniska signifikansen av denna interaktion sannolikt är minimal, bör försiktighet iakttas när läkemedel som metaboliseras på detta sätt administreras.
Medel vars nivåer i blodet kan påverkas av Elvanse
Guanfacin i depotberedning: I en läkemedelsinteraktionsstudie gav administrering av guanfacin i depotberedning i kombination med Elvanse upphov till en ökning av den maximala plasmakoncentrationen av guanfacin med 19 %, medan exponeringen (arean under kurvan, AUC) ökade med 7 %. Dessa små förändringar förväntas inte vara kliniskt betydelsefulla. Ingen effekt på exponeringen för dexamfetamin observerades i denna studie efter samtidig administrering av guanfacin i depotberedning och Elvanse.
Venlafaxin i depotberedning: Administrering av depotberedning av venlafaxin 225 mg, ett CYP2D6-substrat, i kombination med 70 mg Elvanse gav i en läkemedelsinteraktionsstudie upphov till en minskning av Cmax med 9 % och en minskning av AUC med 17 % för den primära aktiva metaboliten O-desmetylvenlafaxin samt en ökning av Cmax med 10 % och en ökning av AUC med 13 % för venlafaxin. Dexamfetamin kan vara en svag hämmare av CYP2D6. Lisdexamfetamin har ingen påverkan på AUC och Cmax för venlafaxin i kombination med O-desmetylvenlafaxin. Dessa små förändringar förväntas inte vara kliniskt betydelsefulla. Ingen effekt på exponeringen för dexamfetamin observerades i denna studie efter samtidig administrering av venlafaxine i depotberedning och Elvanse.
Medel och tillstånd som förändrar urinens pH-värde och påverkar urinutsöndringen och halveringstiden för amfetamin
Askorbinsyra och andra medel och tillstånd (kost som är rik på frukt och grönsaker, urinvägsinfektion och kräkningar) som surgör urinen, ökar urinutsöndringen och minskar halveringstiden för amfetamin. Natriumbikarbonat och andra medel och tillstånd (tiaziddiuretika, kost som är rik på animaliskt protein, diabetes och respiratorisk acidos) som alkaliserar urinen, minskar urinutsöndringen och förlänger halveringstiden för amfetamin.
Monoaminoxidashämmare
Amfetamin ska inte administreras samtidigt med eller inom 14 dagar efter administrering av monoaminoxidas (MAO)-hämmare då det kan öka frisättningen av noradrenalin och andra monoaminer. Detta kan ge svår huvudvärk och andra tecken på hypertensiv kris. Olika toxiska effekter på nervsystemet och malign hyperpyrexi kan uppträda, ibland med dödlig utgång (se avsnitt 4.3).
Medel vars effekt kan reduceras av amfetaminer
Antihypertensiva läkemedel: Amfetaminer kan minska effekten av guanetidin och andra antihypertensiva läkemedel.
Medel vars effekt kan potentieras av amfetaminer
Amfetaminer potentierar den analgetiska effekten av narkotiska analgetika.
Medel som kan reducera effekterna av amfetaminer
Klorpromazin: Klorpromazin blockerar dopamin- och noradrenalinreceptorerna och hämmar därför de centralstimulerande effekterna av amfetamin.
Haloperidol: Haloperidol blockerar dopaminreceptorerna och hämmar därför de centralstimulerande effekterna av amfetamin.
Litiumkarbonat: De anorektiska and stimulatoriska effekterna av amfetaminer kan hämmas av litiumkarbonat.
Användning tillsammans med alkohol
Det finns begränsade data avseende möjlig interaktion med alkohol.
Interaktioner med laboratorietester
Amfetaminer kan orsaka en signifikant förhöjning av plasmakortikosteroidnivåer. Denna ökning är störst på kvällen. Amfetamin kan påverka mätning av steroider i urin.
4.6 Fertilitet, graviditet och amning
Graviditet
Det finns inga adekvata och välkontrollerade studier av användningen av Elvanse hos gravida kvinnor. Dexamfetamin, den aktiva metaboliten av lisdexamfetamin, passerar placenta.
Lisdexamfetamindimesylat hade ingen påverkan på fosterutveckling eller överlevnad när det gavs peroralt till dräktiga råttor och kaniner (se avsnitt 5.3). Administrering av lisdexamfetamindimesylat till unga råttor förknippades med reducerad tillväxt vid kliniskt relevanta exponeringar.
Läkaren bör diskutera behandling med Elvanse med kvinnor som har börjat menstruera. Elvanse bör endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Amning
Amfetaminer utsöndras i bröstmjölk. Elvanse ska inte användas under amning.
Fertilitet
Amfetamin har inte visat några skadliga effekter på fertiliteten i en studie på råtta (se avsnitt 5.3). Effekt av Elvanse på fertiliteten hos människa har inte undersökts.
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Elvanse kan orsaka yrsel, dåsighet och synstörningar inklusive ackommodationssvårigheter, dubbelseende och dimsyn. Detta kan ha en måttlig effekt på förmågan att framföra fordon och använda maskiner. Patienter bör varnas för dessa biverkningar och instrueras om att de bör undvika potentiellt riskfyllda aktiviteter som att framföra fordon eller använda maskiner om de upplever dessa symtom.
4.8 Biverkningar
Sammanfattning av säkerhetsprofilen
De biverkningar som observerats i samband med behandling med Elvanse motsvarar de som ofta förknippas med användning av stimulantia. Mycket vanliga biverkningar inkluderar nedsatt aptit, insomni, muntorrhet, huvudvärk, viktminskning och smärta i övre delen av buken.
Sammanfattning av biverkningar i tabellform
I tabellen nedan visas samtliga biverkningar baserat på kliniska prövningar och spontan rapportering.
Följande definitioner gäller för den frekvensterminologi som används nedan.
Mycket vanliga (≥ 1/10)
Vanliga (≥ 1/100, < 1/10)
Mindre vanliga (≥ 1/1 000, < 1/100)
Sällsynta (≥ 1/10 000, < 1/1 000)
Mycket sällsynta (≥ 1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data).
En asterisk (*) anger att mer information om respektive biverkning återfinns under tabellen.
Organsystemklass |
Biverkning |
Barn (6 till 12 år) |
Ungdomar (13 till 17 år) |
Vuxna |
|
Immunsystemet |
Anafylaktisk reaktion |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
Överkänslighet |
Mindre vanliga |
Ingen känd frekvens |
Mindre vanliga |
|
|
Metabolism och nutrition |
Nedsatt aptit |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Anorexi |
Vanliga |
Vanliga |
Vanliga |
|
|
Psykiska störningar |
*Insomni |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Agitation |
Mindre vanliga |
Mindre vanliga |
Vanliga |
|
|
Ångest |
Mindre vanliga |
Mindre vanliga |
Vanliga |
|
|
Logorré |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Nedsatt libido |
Ej relevant |
Ej rapporterat |
Vanliga |
|
|
Depression |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Tics |
Vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Affektlabilitet |
Vanliga |
Vanliga |
Mindre vanliga |
|
|
Dysfori |
Mindre vanliga |
Ingen känd frekvens |
Mindre vanliga |
|
|
Eufori |
Ingen känd frekvens |
Mindre vanliga |
Mindre vanliga |
|
|
Psykomotorisk hyperaktivitet |
Vanliga |
Mindre vanliga |
Vanliga |
|
|
Dermatillomani |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Psykotiska episoder |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
|
Mani |
Mindre vanliga |
Ingen känd frekvens |
Mindre vanliga |
|
|
Hallucinationer |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
|
Aggression |
Vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
|
Centrala och perifera nervsystemet |
Huvudvärk |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Yrsel |
Vanliga |
Vanliga |
Vanliga |
|
|
Rastlöshet |
Mindre vanliga |
Mindre vanliga |
Vanliga |
|
|
Tremor |
Mindre vanliga |
Vanliga |
Vanliga |
|
|
Somnolens |
Vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Kramper |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
|
Dyskinesi |
Ingen känd frekvens |
Ingen känd frekvens |
Mindre vanliga |
|
|
Ögon |
Dimsyn |
Mindre vanliga |
Ingen känd frekvens |
Mindre vanliga |
|
Mydriasis |
Vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
|
Hjärtat |
Takykardi |
Mindre vanliga |
Vanliga |
Vanliga |
|
Palpitation |
Mindre vanliga |
Vanliga |
Vanliga |
|
|
Kardiomyopati |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné |
Mindre vanliga |
Vanliga |
Vanliga |
|
Magtarmkanalen |
Muntorrhet |
Vanliga |
Vanliga |
Mycket vanliga |
|
Diarré |
Vanliga |
Vanliga |
Vanliga |
|
|
Smärta i övre delen av buken |
Mycket vanliga |
Vanliga |
Vanliga |
|
|
Illamående |
Vanliga |
Vanliga |
Vanliga |
|
|
Kräkningar |
Vanliga |
Vanliga |
Mindre vanliga |
|
|
Lever och gallvägar |
*Eosinofil hepatit |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
Hud och subkutan vävnad |
Hyperhidros |
Mindre vanliga |
Ingen känd frekvens |
Vanliga |
|
Urtikaria |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Utslag |
Vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
*Angioödem |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
|
*Stevens-Johnsons syndrom |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
|
Reproduktions-organ och bröstkörtel |
Erektil dysfunktion |
Ej relevant |
Mindre vanliga |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Irritabilitet |
Vanliga |
Vanliga |
Vanliga |
|
Trötthet |
Vanliga |
Vanliga |
Vanliga |
|
|
Sprallighet |
Mindre vanliga |
Mindre vanliga |
Vanliga |
|
|
Feber |
Vanliga |
Mindre vanliga |
Mindre vanliga |
|
|
Undersökningar |
Förhöjt blodtryck |
Mindre vanliga |
Vanliga |
Vanliga |
|
*Viktminskning |
Mycket vanliga |
Mycket vanliga |
Vanliga |
Beskrivning av utvalda biverkninga
Insomni
Inkluderar insomni, initial insomni och insomni mitt i natten.
Viktminskning
I en kontrollerad prövning av Elvanse hos barn i åldern 6 till 12 år under fyra veckor var medelviktminskningen från starten till slutet av studien 0,4, 0,9 och 1,1 kg för patienter som tilldelats 30 mg, 50 mg respektive 70 mg Elvanse, jämfört med en viktökning på 0,5 kg för patienter som fick placebo. Högre doser förknippades med större viktminskning efter fyra veckors behandling. Noggrann uppföljning av vikt hos barn i åldern 6 till 12 år som fick Elvanse under 12 månader tyder på att kontinuerlig behandling (dvs. behandling i sju dagar per vecka under hela året) minskar tillväxthastigheten mätt i kroppsvikt, vilket påvisas av en medelförändring från baslinjen normaliserad för ålder och kön i percentil motsvarande ‑13,4 över 1 år. De genomsnittliga percentilerna vid baslinjen (n=271) och 12 månader (n=146) var 60,9 respektive 47,2.
I en kontrollerad prövning av Elvanse hos ungdomar i åldern 13 till 17 år under fyra veckor var medelviktminskningen från starten till slutet av studien 1,2, 1,9 och 2,3 kg för patienter som tilldelats 30 mg, 50 mg respektive 70 mg Elvanse, jämfört med en viktökning på 0,9 kg för patienter som fick placebo. Noggrann uppföljning av vikt hos ungdomar i åldern 13 till 17 år som fick Elvanse under 12 månader tyder på att kontinuerlig behandling (dvs. behandling i sju dagar per vecka under hela året) minskar tillväxthastigheten mätt i kroppsvikt, vilket påvisas av en medelförändring från baslinjen normaliserad för ålder och kön i percentil motsvarande -6,5 över 1 år. De genomsnittliga percentilerna vid baslinjen (n=265) och 12 månader (n=156) var 66,0 respektive 61,5.
Eosinofil hepatit
Inga fall rapporterades i de kliniska studierna.
Angioödem
Inga fall rapporterades i de kliniska studierna.
Stevens-Johnsons syndrom
Inga fall rapporterades i de kliniska studierna.
4.9 Överdosering
Vid behandling av överdosering ska den fördröjda frisättningen av dexamfetamin med Elvanse beaktas.
Symtom på akut överdosering med amfetaminer inkluderar rastlöshet, tremor, hyperreflexi, snabbare andhämtning, förvirring, våldsamhet, hallucinationer, paniktillstånd, hyperpyrexi och rabdomyolys. Stimuleringen av det centrala nervsystemet ger ofta upphov till trötthet och depression. Kardiovaskulära effekter innefattar arytmier, hypertoni eller hypotoni och cirkulatorisk kollaps. Gastrointestinala symtom inkluderar illamående, kräkningar, diarré och magkramper. Livshotande förgiftning föregås vanligtvis av konvulsioner och koma.
Behandling av akut intoxikation med amfetamin är i hög grad symtomatisk och inkluderar magsköljning, tillförsel av aktivt kol och ett laxerande medel samt sedering. Rekommendationer avseende hemodialys eller peritonealdialys kan inte ges, då tillräcklig erfarenhet av dessa metoder saknas. Surgörning av urinen medför ökad utsöndring av amfetamin men anses öka risken för akut njursvikt vid förekomst av myoglobinuri. Om överdoseringen med amfetamin kompliceras av akut svår hypertoni har administrering av fentolamin intravenöst föreslagits. När tillräcklig sedering har uppnåtts orsakar detta dock oftast en gradvis sänkning av blodtrycket.
- FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Centralt verkande sympatomimetika, ATC-kod: N06 BA12.
Verkningsmekanism
Elvanse är en farmakologiskt inaktiv prodrug. Efter oral administrering absorberas lisdexamfetamin snabbt från magtarmkanalen och hydrolyseras primärt av röda blodkroppar till dexamfetamin, som är läkemedlets aktiva beståndsdel.
Amfetaminer är icke-katekolamina sympatomimetiska aminer med CNS-stimulerande aktivitet. Den terapeutiska verkningsmekanismen vid ADHD är inte fullständigt fastställd. Amfetamin tros dock blockera återupptaget av noradrenalin och dopamin till presynaptiska neuron och öka frisättningen av dessa monoaminer till den synaptiska spalten. Prodrogen, lisdexamfetamin, binder inte till bindningsställen som svarar för återupptaget av noradrenalin och dopamin in vitro.
Klinisk effekt och säkerhet
Effekten av Elvanse vid behandling av ADHD har visats i tre kontrollerade prövningar med barn i åldern 6 till 12 år, en kontrollerad studie med ungdomar i åldern 13 till 17 år, en kontrollerad studie med barn och ungdomar (6 till 17 år) och fyra kontrollerade prövningar med vuxna som uppfyllde DSM‑IV‑TR-kriterierna för ADHD.
I kliniska studier som omfattade barn och vuxna kvarstod effekterna av Elvanse i 13 timmar efter dosering hos barn och i 14 timmar hos vuxna när läkemedlet togs en gång dagligen på morgonen.
Pediatrisk population
336 patienter i åldern 6–17 år utvärderades i den pivotala europeiska fas-3-studien SPD489‑325. Denna randomiserade, dubbelblinda, dostitrerade, placebokontrollerade och aktivt kontrollerade studie som pågick i sju veckor visade signifikant bättre effekt för Elvanse än för placebo.
Skattningsskalan ADHD Rating Scale (ADHD-RS) ger ett mått på kärnsymtomen vid ADHD. Den placebojusterade medelreduktionen från baslinjen hos patienter som behandlades med Elvanse var 18,6 (p<0,001) enligt protokollet ADHD-RS-IV Total Score (totalpoäng). Vid varje besök under pågående behandling och i slutet av studien var procentandelen för de patienter som uppfyllde de fördefinierade svarskriterierna (en minskning om ≥ 30 % från baslinjen på ADHD-RS-IV Total Score och ett CGI-I-värde [Clinical Global Impression-Improvement] på 1 eller 2) signifikant högre (p<0,001) för Elvanse jämfört med placebo. Endpoint i denna studie definieras i tabell 1. Resultatet var även signifikant högre för Elvanse jämfört med placebo när de enskilda komponenterna i svarskriterierna utvärderades. Dessutom översteg medelvärdena för ADHD-symtom efter avbrytande av behandlingen inte baslinjevärdena före behandling, vilket tyder på att det inte förekom någon reboundeffekt.
Utöver minskningen av symtom har kliniska studier visat att Elvanse ger markant förbättrade funktionella resultat. Närmare bestämt uppvisade 75,0 % av försökspersonerna med Elvanse i studien SPD489‑325 förbättring (definierad som ”väldigt mycket förbättrad” eller ”mycket förbättrad”) på CGI-I jämfört med 14,2 % med placebo (p<0,001).
En markant förbättring beträffande barns teoretiska prestationer sågs med Elvanse, mätt enligt utvärderingshjälpmedlet Health Related Quality of life (hälsorelaterad livskvalitet), CHIP-CE:PRF (Parent Report Form of the Child Health and Illness Profile-Child Edition – utvärderingsformulär för förälder om barnets hälso- och sjukdomsprofil-barnutgåva) Achievement Domain (området prestation). En signifikant förbättring från baslinjen sågs med Elvanse jämfört med placebo (Elvanse: 9,4 jämfört med placebo ‑1,1) med en genomsnittlig skillnad mellan de två behandlingsgrupperna på 10,5 (p<0,001).
Tabell 1: Behandlingsresultat för studie SPD489-325 vid endpoint1 (komplett analysset)
|
Lisdexamfetamindimesylat |
Placebo |
Metylfenidathydroklorid |
||
|
Förändring av ADHD-RS-IV, total poäng |
||||
|
Least square mean |
-24,3 |
-5,7 |
-18,7 |
|
|
Effektstorlek (jämfört med placebo) |
1,804 |
Ej relevant |
1,263 |
|
|
P-värde (jämfört med placebo) |
<0,001 |
Ej relevant |
<0,001 |
|
|
Behandlingssvar för ADHD-RS-IV |
||||
|
Patienter med behandlingssvar2 |
83,7% (87/104) |
22,6 % (24/106) |
68,2% (73/107) |
|
|
Skillnad i behandlingssvar jämfört med placebo |
61,0 |
Ej relevant |
45,6 |
|
|
P-värde (jämfört med placebo) |
<0,001 |
Ej relevant |
<0,001 |
|
|
Behandlingssvar för CGI-I |
||||
|
Patienter som visade förbättring3 |
75,0 % (78/104) |
14,2 % (15/106) |
58,9 % (63/107) |
|
|
Skillnad i förbättring jämfört med placebo |
60,8 |
Ej relevant |
44,7 |
|
|
P-värde (jämfört med placebo) |
<0,001 |
Ej relevant |
<0,001 |
|
|
Förändring av CHIP-CE: PRF Achievement Domain (området prestation) |
||||
|
Least square mean |
9,4 |
-1,1 |
6,4 |
|
|
Effektstorlek (jämfört med placebo) |
1,280 |
Ej relevant |
0,912 |
|
|
P-värde (jämfört med placebo) |
<0,001 |
Ej relevant |
<0,001 |
|
1 Endpoint = det sista besöket under pågående behandling efter baslinjebesöket under perioden med dosoptimering eller underhållsdos (besök 1–7) med ett giltigt värde
2 Behandlingssvar definieras som procentuell minskning från baslinjen på ADHD-RS-IV Total Score ≥ 30 %
3Förbättring (”väldigt mycket förbättrad” eller ”mycket förbättrad”)
Liknande resultat för ADHD‑RS och CGI‑I sågs i två placebokontrollerade studier: en med barn (n=297) och den andra med ungdomar (n=314), båda genomförda i USA.
Bibehållen effekt har även påvisats i en dubbelblind, placebokontrollerad, randomiserad utsättningsstudie som genomfördes med barn och ungdomar i åldern 6 till 17 år (n=157) som uppfyllde kriterierna för ADHD enligt DSM-IV. Patienterna fick optimerad behandling med Elvanse i en öppen förlängningsstudie (minst 26 veckor) innan de påbörjade den sex veckor långa randomiserade utsättningsperioden. Lämpliga patienter randomiserades till att fortsätta med optimerad dos av Elvanse eller att byta till placebo. Patienterna observerades med avseende på symtomrecidiv (behandlingssvikt) under den sex veckor långa dubbelblinda fasen. Behandlingssvikt definierades som en ökning (försämring) om ≥ 50 % av ADHD-RS Total Score (totalpoäng) och en ökning med ≥ 2 poäng på CGI-S-skalan jämfört med poängen när den dubbelblinda randomiserade utsättningsfasen påbörjades. Behandlingssvikt var signifikant lägre (p<0,001) för försökspersonerna med Elvanse (15,8 %) jämfört med placebo (67,5 %). För majoriteten av patienterna (70,3 %) som fick behandlingssvikt oavsett behandling blev ADHD-symtomen förvärrade vid eller före besöket i vecka 2 efter randomisering.
Vuxen population
Effekten av Elvanse i behandlingen av ADHD fastställdes i en dubbelblind, randomiserad, placebokontrollerad, parallelgruppsstudie som utfördes med 420 vuxna patienter i åldern 18 till 55 år som uppfyllde kriterierna för ADHD enligt DSM-IV. Signifikant förbättring av symtomen på ADHD, baserat på prövarens skattningar på skalan ADHD‑RS with adult prompts Total Score (med signaler från vuxna, totalpoäng), observerades för alla Elvanse-doser jämfört med placebo. Behandling med Elvanse minskade signifikant graden av funktionsnedsättning mätt efter förbättring på skattningsskalan CGI-I jämfört med placebo.
Bibehållen effekt har dessutom påvisats i en dubbelblind, placebokontrollerad, randomiserad utsättningsstudie som genomfördes med vuxna (n=123) som uppfyllde kriterierna för ADHD enligt DSM-IV och som, vid starten av studien, hade behandlats med Elvanse under minst sex månader. En signifikant lägre andel patienter som behandlades med Elvanse uppfyllde kriterierna för recidiv (8,9 %) jämfört med patienter som fick placebo (75,0 %) i den dubbelblinda randomiserade utsättningsfasen. Recidiv definierades som en ökning med ≥ 50 % från randomisering på ADHD-RS-IV Total Score (totalpoäng) och en ökning med ≥ 2 poäng på CGI-S-skalan i förhållande till poäng på CGI-skalan vid randomisering.
Studier av risk för missbruk
I en humanstudie av risk för missbruk, där perorala doser som motsvarade 100 mg lisdexamfetamindimesylat och 40 mg dexamfetaminsulfat med omedelbar frisättning gavs till individer med läkemedelsmissbruk i anamnesen, gav lisdexamfetamindimesylat 100 mg subjektiva svar på en skala med ”att tycka om läkemedlet” (”Drug Liking Effects”) (primärt effektmått) som var signifikant lägre än för dexamfetamin 40 mg med omedelbar frisättning. Oral administrering av 150 mg lisdexamfetamindimesylat gav dock en ökning av de positiva subjektiva svaren på denna skala som var jämförbar med de positiva subjektiva svaren som gavs med 40 mg peroralt dexamfetamin med omedelbar frisättning och 200 mg dietylpropion.
Intravenös administrering av 50 mg lisdexamfetamindimesylat till individer med drogmissbruk i anamnesen gav positiva subjektiva svar på skalor som mätte ”att tycka om läkemedlet” (”Drug Liking”), ”eufori”, ”amfetamineffekter” och ”benzedrineffekter” som var större än med placebo men mindre än de som gavs med en motsvarande dos (20 mg) av intravenöst dexamfetamin.
5.2 Farmakokinetiska egenskaper
Absorption
Efter peroral administrering absorberas lisdexamfetamindimesylat snabbt från magtarmkanalen hos friska vuxna och barn (6 till 12 år) med ADHD, vilket antas medieras av den höga kapaciteten hos PEPT1-transportörer.
Födointag påverkar inte AUC och Cmax för dexamfetamin hos friska vuxna efter administrering av peroral engångsdos av Elvanse 70 mg kapsel, men Tmax förlängs med cirka 1 timme (från 3,8 timmar i fastande tillstånd till 4,7 timmar efter måltid med högt fettinnehåll). Efter åtta timmars fasta var AUC-värdet för dexamfetamin efter peroral administrering av lisdexamfetamindimesylat som lösning och som intakt kapsel likvärdigt,
Distribution
Hos 18 barn (6 till 12 år) med ADHD var Tmax för dexamfetamin cirka 3,5 timmar efter oral engångsdos av lisdexamfetamindimesylat i styrkan 30 mg, 50 mg eller 70 mg administrerat efter åtta timmars fasta (över natten). Tmax för lisdexamfetamindimesylat var cirka 1 timme. Dexamfetamin uppvisar linjär farmakokinetik efter administrering av oral engångsdos av lisdexamfetamindimesylat i dosintervallet 30 mg till 70 mg hos barn i åldern 6 till 12 år.
Vikt-/dosnormaliserat AUC och Cmax var 22 % respektive 12 % lägre hos vuxna kvinnor än hos män dag sju efter dosering med 70 mg lisdexamfetamin per dag i sju dagar. Vikt-/dosnormaliserade AUC- och Cmax-värden låg på samma nivå hos flickor och pojkar efter engångsdoser om 30–70 mg.
Det sker ingen ackumulering av varken dexamfetamin vid steady state hos friska vuxna eller av lisdexamfetamindimesylat efter dosering en gång dagligen i sju på varandra följande dagar.
Metabolism
Lisdexamfetamindimesylat omvandlas till dexamfetamin och L-lysin, vilket sker genom metabolism i blodet, huvudsakligen genom den hydrolytiska aktiviteten hos röda blodkroppar. Röda blodkroppar har hög kapacitet för metabolism av lisdexamfetamin då in vitro-data visat att påtaglig hydrolys sker även vid låga nivåer av erytrocytvolymfraktion. Lisdexamfetamin metaboliseras inte av cytokrom P450-enzymer.
Amfetamin oxideras på position 4 i bensenringen för att bilda 4‑hydroxyamfetamin eller på alfa- eller beta-kol i sidokedjan för att bilda alfa‑hydroxyamfetamin eller norefedrin. Norefedrin och 4‑hydroxyamfetamin är båda aktiva substanser som var och en oxideras för att bilda 4‑hydroxynorefedrin. Alfa‑hydroxyamfetamin genomgår deaminering för att bilda fenylaceton, som slutligen bildar bensoesyra och dess glukuronid och glycinkonjugatet hippursyra. Även om de enzymer som är involverade i metabolismen av amfetamin inte är fullständigt fastställda, vet man att CYP2D6 är involverat i bildningen av 4‑hydroxyamfetamin.
Eliminering
Efter peroral administrering av en dos om 70 mg radioaktivt märkt lisdexamfetamindimesylat till sex friska försökspersoner återfanns cirka 96 % av den radioaktiva perorala dosen i urinen och enbart 0,3 % återfanns i feces under en period av 120 timmar. Av den radioaktivitet som återfanns i urinen kunde 42 % av dosen hänföras till amfetamin, 25 % till hippursyra och 2 % till intakt lisdexamfetamin. Plasmakoncentrationer av icke omvandlat lisdexamfetamin är övergående låga och blir vanligtvis icke kvantifierbara åtta timmar efter administrering. Elimineringshalveringstiden i plasma för lisdexamfetamin var i genomsnitt mindre än en timme i studier av lisdexamfetamindimesylat hos frivilliga försökspersoner. Halveringstiden för dexamfetamin är 11 timmar.
Särskilda populationer
Motsvarande farmakokinetik för dexamfetamin finns hos barn (6 till 12 år) och ungdomar (13 till 17 år) med ADHD samt hos friska vuxna försökspersoner. Eventuella skillnader i kinetiken efter peroral administrering beror på skillnader i dosering i mg/kg.
Den systemiska exponeringen för dexamfetamin är likartad för män och kvinnor som får samma dos i mg/kg.
Inga formella farmakokinetiska studier avseende ras har utförts. Det finns inga belägg för påverkan av etniskt ursprung på farmakokinetiken för Elvanse
I en studie med 47 försökspersoner i åldern 55 år eller äldre var clearance av amfetamin cirka 0,7 l/h/kg för försökspersoner 55 till 74 år och 0,55 l/h/kg för försökspersoner ≥ 75 år. Detta värde är något lägre jämfört med yngre vuxna (cirka 1 l/h/kg för försökspersoner i åldern 18 till 45 år). Minskat clearance av amfetamin verkar inte vara relaterat till njurfunktionen enligt beräknat kreatininclearance.
5.3 Prekliniska säkerhetsuppgifter
I toxikologiska studier med upprepad dosering var de viktigaste fynden beteendeförändringar, såsom ökad aktivitet typisk för administrering av stimulantia med en associerad minskning av viktutveckling, tillväxt och födointag, som anses vara ett resultat av ett förstärkt farmakologiskt svar.
Lisdexamfetamindimesylat var inte genotoxiskt in vitro i Ames test och muslymfomtest eller in vivo i mikrokärntest med benmärg från mus. Karcinogenicitetsstudier med lisdexamfetamindimesylat har inte utförts. Inga tecken på karcinogenicitet noterades i studier där d- och l‑amfetamin (enantiomerkvot 1:1) gavs under två år i fodret till möss och råttor i doser upp till 30 mg/kg/dag till möss av hankön, 19 mg/kg/dag till möss av honkön och 5 mg/kg/dag till råttor av han- och honkön.
Lisdexamfetamindimesylat hade ingen påverkan på fosterutveckling eller överlevnad när det gavs oralt till dräktiga råttor i doser upp till 40 mg/kg/dag och till kaniner i doser upp till 120 mg/kg/dag.
Inga biverkningar på utvecklingen av nervsystemet eller reproduktiv funktion observerades efter upprepad dosering av lisdexamfetamindimesylat till unga råttor och hundar.
Amfetamin (d- till l‑enantiomerkvot 3:1) hade inga biverkningar på fertilitet eller tidig embryonal utveckling hos råtta vid doser upp till 20 mg/kg/dag.
Ett antal studier på gnagare tyder på att prenatal eller tidig postnatal exponering för amfetamin (d- eller d, l-) vid doser jämförbara med dem som används kliniskt kan leda till långsiktiga neurokemiska och beteendemässiga förändringar. Rapporterade beteendeeffekter innefattar nedsatt inlärnings- och minnesförmåga, förändringar av rörelseförmågan och förändringar i sexuell funktion. Liknande studier har inte utförts med Elvanse.
- FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Mikrokristallin cellulosa
Kroskarmellosnatrium
Magnesiumstearat
Kapselhölje
Gelatin
Svart bläck (shellack och svart järnoxid E172).
Färgämnen i kapselhöljet:
30 mg: titandioxid (E171) och erytrosin (E127)
50 mg: titandioxid (E171) och brilliantblått FCF (E133)
70 mg:titandioxid (E171), brilliantblått FCF (E133) och erytrosin (E127)
6.2 Inkompatibiliteter
Ej relevant.
6.3 Hållbarhet
2 år.
6.4 Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
6.5 Förpackningstyp och innehåll
Burk av högdensitetspolyeten (HDPE) och barnskyddande polypropenlock med inre folieförslutning.
Förpackningsstorlekar: 28 eller 30.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
6.6 Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar
- DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
2013-07-22

